ASSORBIMENTO DI AMINOACIDI E PEPTIDI DA PARTE DELLE PIANTE
A cura di: Joshua R. Widhalm, Dipartimento di Orticoltura e Architettura del Paesaggio, Università Purdue, Stati Uniti
e-mail: jwidhalm@purdue.edu

Gli amminoacidi sono mattoni fondamentali per la sintesi delle proteine in tutti gli organismi. Nelle piante, gli aminoacidi liberi "proteinogenici" svolgono ruoli aggiuntivi nell'assimilazione e nel trasporto dell'azoto, come composti di segnalazione, come osmoliti e come precursori per la produzione di vari ormoni, cofattori e altri composti importanti come la clorofilla. Le piante utilizzano gli aminoacidi anche per produrre collettivamente migliaia di composti specializzati che facilitano le interazioni ecologiche e forniscono risposte adattive agli stress ambientali.
Gli aminoacidi nelle piante possono anche essere legati in forme polimeriche come piccoli peptidi, che sono tipicamente composti da 5-60 aminoacidi. Alcuni piccoli peptidi svolgono funzioni ormonali nella crescita e nello sviluppo delle piante (Roy et al., 2018). Altri funzionano in risposta a ferite, infezioni da patogeni, squilibri nutritivi, siccità o elevata salinità (Chen et al., 2020). Mentre molti piccoli peptidi prodotti endogenamente sono codificati dai geni, alcuni sono prodotti attraverso la scissione di preproteine e modifiche post-traslazionali (Matsubayashi, 2014). Anche i peptidi applicati esternamente come componenti di idrolizzati proteici o quelli prodotti sinteticamente con sequenze casuali sono stati trovati in grado di suscitare attività biologiche (Roy et al., 2018). Tuttavia, la comprensione dei meccanismi molecolari alla base del modo in cui gli aminoacidi liberi e le loro forme polimeriche - come peptidi e proteine - vengono assunti dall'ambiente ha iniziato a emergere solo di recente.
Le indagini sui processi biochimici che mediano l'assorbimento e il trasporto di aminoacidi e peptidi sono iniziate negli anni '80 e '90 con saggi di assorbimento utilizzando vescicole di membrana isolate da vari tessuti vegetali. Utilizzando substrati marcati radioattivamente e metodi di etichettatura fluorescente, è stata rivelata la presenza di molteplici sistemi di trasporto di aminoacidi e peptidi (Tegeder e Rentsch, 2010). Da allora, nella specie modello non micorrizica Arabidopsis thaliana sono stati identificati membri di almeno una dozzina di famiglie di trasportatori. Studi funzionali - utilizzando una combinazione di sistemi di espressione eterologa, linee di knockout e sovraespressione genica e analisi dell'espressione per determinare la localizzazione di organi/tessuti - hanno rivelato il ruolo dei trasportatori nell'assorbimento di aminoacidi dal suolo, nell'importazione ed esportazione cellulare e/o nel trasporto a lunga distanza attraverso il sistema vascolare della pianta (Tegeder, 2014).
I trasportatori localizzati sulla membrana plasmatica coinvolti nell'assorbimento degli aminoacidi da parte delle radici appartengono a tre famiglie all'interno della superfamiglia dei trasportatori di aminoacidi-poliamino-colina (APC): (i) le Amino Acid Permeases (AAPs), che funzionano come trasportatori di ampi substrati con affinità moderata; (ii) i Lysine/Histidine-like Transporters (LHTs), che importano aminoacidi neutri e acidi; e (iii) i Proline and Glycine Betaine Transporters (ProTs), che trasportano gli osmoliti prolina e glicina betaina (Tegeder e Masclaux-Daubresse, 2018).

AtPTR1, un membro della famiglia peptide transporter/nitrato transporter 1 (PTR), è coinvolto nell'assorbimento dei dipeptidi nelle radici (Komarova et al., 2008) (Figura 1). Oltre a questo, si sa poco altro sull'assorbimento dei peptidi nelle radici, anche se è probabile che siano coinvolti altri PTR e membri delle famiglie ATP Binding Cassette (ABC) transporter e Oligopeptide Transporter (OPT) (Tegeder e Rentsch, 2010; Roy et al., 2018).
Nelle piante micorrizate, i funghi simbionti contribuiscono all'assorbimento di aminoacidi e peptidi. Le micorrize presentano anche attività proteolitiche che, insieme a quelle dei microbi a vita libera del suolo, rendono disponibili alle piante gli aminoacidi legati alle proteine e ai peptidi (Näsholm et al., 2009) (Figura 1).
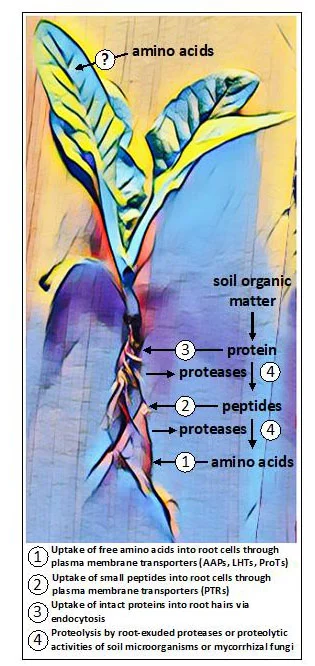
Figura 1. Potenziali vie di assorbimento degli aminoacidi riscontrate collettivamente nelle piante. Nelle radici, gli aminoacidi possono essere assunti in forma libera (monomerica) o in forma polimerica come piccoli peptidi o proteine. Alcune piante rilasciano proteasi per convertire le proteine e i peptidi presenti nel terreno in aminoacidi liberi, mentre altre piante si affidano alle attività dei funghi simbionti per la proteolisi e l'assorbimento. Le prove emergenti indicano che alcune piante possono essere in grado di acquisire aminoacidi applicati esogenamente ai tessuti aerei, anche se le vie di assorbimento presunte sono sconosciute.
Solo recentemente è stato scoperto che le radici di diverse piante non micorriziche trasudano enzimi proteolitici appartenenti alla famiglia delle cisteina-proteasi (Adamczyk et al., 2010) in grado di scindere le proteine sulla superficie della radice e nell'apoplasto della corteccia radicale (Paungfoo-Lonhienne et al., 2008). I piccoli peptidi e gli aminoacidi liberi rilasciati sono quindi disponibili per l'assorbimento da parte di trasportatori localizzati sulla membrana plasmatica. Le membrane delle cellule vegetali contengono anche chinasi recettoriali ricche di leucina (LRR-RK) che percepiscono ligandi peptidici e proteici (Hohmann et al., 2017). Questi recettori costituiscono il primo strato del sistema immunitario delle piante e i membri espressi nelle radici contribuiscono a controllare la formazione di barriere di diffusione nella fascia di Casparian (Okuda et al., 2020). Le proteine intatte sono anche in grado di entrare nei peli delle radici per endocitosi e vengono poi digerite all'interno delle cellule vegetali (Paungfoo-Lonhienne et al., 2008).
Nel suolo, le piante sono facilmente superate dai microrganismi per l'azoto organico. I microbi hanno tassi di ricambio più rapidi e rapporti superficie/volume più ampi, che consentono loro un maggiore accesso ai substrati nel suolo. Ciò fa sorgere dubbi sulla misura in cui aminoacidi, peptidi e proteine fungono da fonti significative di azoto per le piante (Näsholm et al., 2009). Poiché gli aminoacidi, i peptidi e le proteine applicati esogenamente hanno effetti benefici (Colla et al., 2017b) che vanno oltre il metabolismo dell'azoto, ciò potrebbe indicare altri ruoli per gli aminoacidi e i peptidi assunti dal suolo.
Sebbene molte ricerche si siano concentrate sull'acquisizione di aminoacidi dal suolo, alcune piante sono in grado di assumerli attraverso i tessuti aerei. Nelle trappole di piante carnivore come le Nepenthes, ad esempio, i nutrienti rilasciati dalla preda digerita, tra cui aminoacidi, peptidi e proteine, vengono recuperati dalla pianta. Dopo la digestione, le molecole penetrano nella cuticola attraverso i pori ed entrano nell'apoplasto dove vengono endocitate nelle cellule, quindi traslocate verso il mesofillo e ulteriormente incorporate nel metabolismo (Adlassnig et al., 2012).
Le piante epifite (note anche come "piante aeree") ricavano l'umidità e le sostanze nutritive principalmente dall'aria e da altri detriti non terrosi che le circondano. Queste piante non parassitarie crescono sopra altre piante e comprendono molti tipi di muschi, felci, orchidee e bromeliacee. Le briofite epifite, che non hanno barriere cuticolari e non hanno sistemi radicali e vascolari sviluppati, hanno dimostrato con studi di marcatura con 15N diassumere glicina attraverso l'applicazione fogliare (Song et al., 2016). Le bromeliacee epifite, come il "muschio spagnolo" (Tillandsia usneoides) e la "pianta aerea panciuta" (T. paucifolia), sono monocotiledoni non parassite con sistemi vascolari ridotti che usano le radici per attaccarsi alle piante vicine e poi raccogliere i nutrienti, compresi gli aminoacidi, attraverso tricomi fogliari specializzati (Nyman et al., 1987).
E altri tipi di piante? Studi di tracciatura con aminoacidi marcati con 15Nhanno dimostrato che le foglie di bentgrass strisciante (Stiegler et al., 2013) e di pesco (Furuya e Umemiya, 2002) sono in grado di assorbire aminoacidi attraverso il fogliame. Un recente studio di McCoy et al. (McCoy et al., 2020) ha inoltre dimostrato che il glutammato con doppia marcatura 15N,13C, applicato esogenamente al fogliame della gramigna, viene incorporato in prolina e acido γ-aminobutirrico (GABA). Questo lavoro è significativo perché suggerisce che la mineralizzazione sulla superficie fogliare è un destino minore per gli aminoacidi applicati e dimostra che gli aminoacidi forniti esogenamente possono essere incorporati nel metabolismo delle piante.

È stato osservato che le applicazioni fogliari di idrolizzati proteici aumentano la produttività, la tolleranza agli stress ambientali e altre caratteristiche fisiologiche in diverse specie di interesse agricolo, tra cui il pomodoro (Colla et al., 2017a), gli alberi da frutto (Tanou et al., 2017) e la soia (Teixeira et al., 2018). Sebbene le applicazioni contengano spesso tensioattivi per aumentare la permeabilità degli aminoacidi idrofili e dei piccoli peptidi attraverso la cuticola idrofobica, anche altri fattori, come il clima (Pecha et al., 2012) e la presenza di pori acquosi (Schönherr, 2006), influenzano l'assorbimento.
Una volta che gli amminoacidi e i peptidi attraversano la barriera cuticolare, entrano nello spazio della parete cellulare (apoplasto) dove possono essere assorbiti da uno o più trasportatori localizzati sulla membrana plasmatica. Da qui, possono anche legare a priori le LRR-RK o essere trasportati in altre parti della pianta. La via più probabile per il trasporto a lunga distanza è la via floematica apoplastica, che importa gli amminoacidi dall'apoplasto al floema (Tegeder e Masclaux-Daubresse, 2018). I trasportatori coinvolti includono membri della stessa classe di AAP che contribuiscono all'assorbimento radicale di aminoacidi dal suolo (Santiago e Tegeder, 2016). È interessante notare che il funzionamento della via floematica apoplastica nelle piante si basa tipicamente sull'esportazione di aminoacidi dalle cellule di origine della foglia nell'apoplasto. Si può quindi immaginare che l'apporto esogeno di aminoacidi attraverso il fogliame bypassi di fatto questa fase, influenzando così gli aspetti della qualità dei frutti e dell'architettura radicale osservati quando si applicano biostimolanti a base di idrolizzati proteici (Colla et al., 2015).



