ABSORCIÓN DE AMINOÁCIDOS Y PÉPTIDOS POR LAS PLANTAS
Por: Joshua R. Widhalm, Departamento de Horticultura y Arquitectura del Paisaje, Universidad de Purdue, Estados Unidos
correo electrónico: jwidhalm@purdue.edu

Los aminoácidos son componentes vitales para la síntesis de proteínas en todos los organismos. En las plantas, los aminoácidos "proteinogénicos" libres desempeñan funciones adicionales en la asimilación y el transporte de nitrógeno, como compuestos de señalización, como osmolitos y como precursores para fabricar diversas hormonas, cofactores y otros compuestos importantes como la clorofila. Las plantas también utilizan aminoácidos para producir colectivamente miles de compuestos especializados que facilitan las interacciones ecológicas y proporcionan respuestas adaptativas al estrés ambiental.
Los aminoácidos de las plantas también pueden unirse en formas poliméricas como pequeños péptidos, que suelen estar compuestos de 5 a 60 aminoácidos. Algunos péptidos pequeños desempeñan funciones similares a las hormonas en el crecimiento y desarrollo de las plantas (Roy et al., 2018). Otros funcionan en respuesta a heridas, infección por patógenos, desequilibrio de nutrientes, sequía o alta salinidad (Chen et al., 2020). Mientras que muchos péptidos pequeños producidos endógenamente están codificados por genes, algunos se producen a través de la escisión de preproteínas y modificaciones postraduccionales (Matsubayashi, 2014). También se ha descubierto que los péptidos aplicados externamente como componentes de hidrolizados de proteínas o los producidos sintéticamente con secuencias aleatorias provocan actividades biológicas (Roy et al., 2018). Sin embargo, solo recientemente se han empezado a comprender los mecanismos moleculares que subyacen a la forma en que los aminoácidos libres y sus formas poliméricas -como péptidos y proteínas- son absorbidos del medio ambiente.
Las investigaciones sobre los procesos bioquímicos que median en la captación y el transporte de aminoácidos y péptidos comenzaron en las décadas de 1980 y 1990 con ensayos de captación utilizando vesículas de membrana aisladas de diversos tejidos vegetales. Utilizando sustratos marcados radiactivamente y métodos de etiquetado fluorescente, se reveló la existencia de múltiples sistemas de transporte de aminoácidos y péptidos (Tegeder y Rentsch, 2010). Desde entonces, se han identificado miembros de al menos una docena de familias de transportadores en la especie modelo no micorrícica Arabidopsis thaliana. Estudios funcionales -utilizando una combinación de sistemas de expresión heteróloga, líneas de sobreexpresión y knockout de genes, y análisis de expresión para determinar la localización de órganos/tejidos- han revelado el papel de los transportadores en la absorción de aminoácidos del suelo, la importación y exportación celular, y/o el transporte a larga distancia a través del sistema vascular de la planta (Tegeder, 2014).
Los transportadores localizados en la membrana plasmática que intervienen en la absorción de aminoácidos por las raíces pertenecen a tres familias de la superfamilia de transportadores de aminoácidos, poliamina y colina (APC): (i) las permeasas de aminoácidos (AAPs), que funcionan como transportadores de sustratos amplios con afinidades moderadas; (ii) los transportadores similares a la lisina/histidina (LHTs), que importan aminoácidos neutros y ácidos; y (iii) los transportadores de prolina y glicina betaína (ProTs), que transportan los osmolitos prolina y glicina betaína (Tegeder y Masclaux-Daubresse, 2018).

AtPTR1, un miembro de la familia del transportador de péptidos/transportador de nitratos 1 (PTR) está implicado en la captación de dipéptidos en las raíces (Komarova et al., 2008) (Figura 1). Aparte de esto, poco más se sabe de la captación de péptidos por las raíces, aunque es probable que participen otros PTR y miembros de las familias de transportadores ATP Binding Cassette (ABC) y transportadores de oligopéptidos (OPT) (Tegeder y Rentsch, 2010; Roy et al., 2018).
En las plantas micorrizadas, los hongos simbiontes contribuyen a la absorción de aminoácidos y péptidos. Las micorrizas también presentan actividades proteolíticas que, junto con las de los microbios de vida libre del suelo, ponen a disposición de las plantas aminoácidos unidos a proteínas y péptidos (Näsholm et al., 2009) (Figura 1).
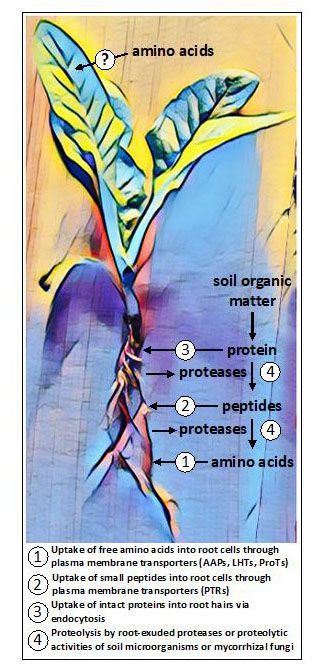
Figura 1. Vías potenciales de absorción de aminoácidos que se encuentran colectivamente en las plantas. En las raíces, los aminoácidos pueden ser absorbidos en sus formas libres (monoméricas) o en formas poliméricas como pequeños péptidos o proteínas. Algunas plantas liberan proteasas para convertir las proteínas y los péptidos del suelo en aminoácidos libres, mientras que otras dependen de las actividades de hongos simbiontes para la proteólisis y la absorción. Cada vez hay más pruebas que indican que algunas plantas pueden adquirir aminoácidos aplicados de forma exógena a los tejidos aéreos, aunque se desconocen las posibles vías de absorción.
Recientemente se ha descubierto que las raíces de varias plantas no micorrícicas exudan enzimas proteolíticas pertenecientes a la familia de las cisteína proteasas (Adamczyk et al., 2010) que pueden descomponer proteínas en la superficie de la raíz y en el apoplasto de la corteza radicular (Paungfoo-Lonhienne et al., 2008). Los pequeños péptidos liberados y los aminoácidos libres están entonces disponibles para ser absorbidos por transportadores localizados en la membrana plasmática. Las membranas de las células vegetales también contienen receptores quinasa ricos en leucina (LRR-RK) que detectan ligandos peptídicos y proteicos (Hohmann et al., 2017). Estos receptores forman la primera capa del sistema inmunitario de las plantas y los miembros expresados en las raíces ayudan a controlar la formación de barreras de difusión en la franja de Casparian (Okuda et al., 2020). Al parecer, las proteínas intactas también pueden entrar en los pelos radiculares por endocitosis y luego son digeridas dentro de las células vegetales (Paungfoo-Lonhienne et al., 2008).
En el suelo, los microorganismos superan fácilmente a las plantas en la competencia por el nitrógeno orgánico. Los microbios tienen tasas de renovación más rápidas y una mayor relación superficie/volumen, lo que les da un mayor acceso a los sustratos del suelo. Esto plantea la cuestión de hasta qué punto los aminoácidos, los péptidos y las proteínas son fuentes importantes de nitrógeno para las plantas (Näsholm et al., 2009). Dado que los aminoácidos, péptidos y proteínas aplicados exógenamente tienen efectos beneficiosos (Colla et al., 2017b) más allá del metabolismo del nitrógeno, esto puede apuntar a otras funciones de los aminoácidos y péptidos tomados del suelo.
Aunque muchas investigaciones se han centrado en la adquisición de aminoácidos del suelo, algunas plantas son capaces de absorberlos a través de tejidos aéreos. En las trampas pitfall de plantas carnívoras como las especies Nepenthes, por ejemplo, los nutrientes liberados por las presas digeridas, incluidos aminoácidos, péptidos y proteínas, son recuperados por la planta. Tras la digestión, las moléculas penetran en la cutícula a través de poros y entran en el apoplasto, donde son endocitadas en las células y, a continuación, translocadas hacia el mesófilo e incorporadas al metabolismo (Adlassnig et al., 2012).
Las plantas epífitas (también conocidas como "plantas del aire") obtienen principalmente la humedad y los nutrientes del aire y de otros restos no terrestres que las rodean. Estas plantas no parasitarias crecen encima de otras plantas e incluyen muchos tipos de musgos, helechos, orquídeas y bromelias. En estudios de etiquetado con 15Nse demostró que las briofitas epifíticas, que no tienen barreras de cutícula y carecen de sistemas radiculares y vasculares desarrollados, absorben glicina mediante aplicación foliar (Song et al., 2016). Las bromeliáceas epífitas, como el "musgo español" (Tillandsia usneoides) y la "planta de aire panzuda" (T. paucifolia), son monocotiledóneas no parásitas con sistemas vasculares reducidos que utilizan sus raíces para adherirse a plantas cercanas y luego recoger nutrientes, incluidos aminoácidos, a través de tricomas foliares especializados (Nyman et al., 1987).
¿Qué ocurre con otros tipos de plantas? Los estudios de rastreo con aminoácidos marcados con 15N demostraron que las hojas de creeping bentgrass (Stiegler et al., 2013) y melocotonero (Furuya y Umemiya, 2002) son capaces de absorber aminoácidos a través de su follaje. Un estudio reciente de McCoy et al. (McCoy et al., 2020) demostró además que el glutamato doblemente etiquetado con 15N,13Caplicado exógenamente al follaje del creeping bentgrass se incorpora a la prolina y al ácido γ-aminobutírico (GABA). Este trabajo es significativo porque sugiere que la mineralización en la superficie de la hoja es un destino menor para los aminoácidos aplicados y demuestra que los aminoácidos suministrados exógenamente pueden incorporarse al metabolismo de la planta.

Se ha observado que la aplicación foliar de hidrolizados de proteínas aumenta la productividad, la tolerancia al estrés ambiental y otras características fisiológicas en varias especies de interés agrícola, como el tomate (Colla et al., 2017a), los árboles frutales (Tanou et al., 2017) y la soja (Teixeira et al., 2018). Aunque las aplicaciones suelen contener tensioactivos para aumentar la permeabilidad de los aminoácidos hidrofílicos y los péptidos pequeños a través de la cutícula hidrofóbica, otros factores, como el clima (Pecha et al., 2012) y la presencia de poros acuosos (Schönherr, 2006) también afectan a la absorción.
Una vez que los aminoácidos y los péptidos atraviesan la barrera de la cutícula, entran en el espacio de la pared celular (apoplasto), donde pueden ser absorbidos por uno o varios transportadores localizados en la membrana plasmática. Desde aquí, también pueden -a priori- unirse a las LRR-RK o ser transportados a otras partes de la planta. La ruta más probable de transporte a larga distancia es a través de la vía del floema apoplástico, que importa aminoácidos del apoplasto al floema (Tegeder y Masclaux-Daubresse, 2018). Los transportadores implicados incluyen miembros de la misma clase de AAP que contribuyen a la captación radicular de aminoácidos del suelo (Santiago y Tegeder, 2016). Es interesante señalar que el funcionamiento de la vía del floema apoplástico en las plantas se basa normalmente en la exportación de aminoácidos de las células fuente de las hojas al apoplasto. Por lo tanto, se puede prever que el suministro exógeno de aminoácidos a través del follaje en efecto evita este paso, influyendo así en aspectos de la calidad de la fruta y la arquitectura de la raíz observados cuando se aplican bioestimulantes basados en hidrolizados de proteínas (Colla et al., 2015).



