ПОГЛОЩЕНИЕ РАСТЕНИЯМИ АМИНОКИСЛОТ И ПЕПТИДОВ
По: Джошуа Р. Видхальм, факультет садоводства и ландшафтной архитектуры, Университет Пердью, США
e-mail: jwidhalm@purdue.edu

Аминокислоты являются жизненно важными строительными блоками для синтеза белков во всех организмах. В растениях свободные "протеиногенные" аминокислоты играют дополнительную роль в усвоении и переносе азота, в качестве сигнальных соединений, осмолитов и предшественников для производства различных гормонов, кофакторов и других основных соединений, таких как хлорофилл. Растения также используют аминокислоты для коллективного производства тысяч специализированных соединений, которые облегчают экологические взаимодействия и обеспечивают адаптивную реакцию на стрессы окружающей среды.
Аминокислоты в растениях также могут быть связаны в полимерные формы в виде малых пептидов, которые обычно состоят из 5-60 аминокислот. Некоторые малые пептиды играют гормоноподобную роль в росте и развитии растений (Roy et al., 2018). Другие функционируют в ответ на ранение, заражение патогенами, дисбаланс питательных веществ, засуху или высокую соленость (Chen et al., 2020). В то время как многие эндогенно продуцируемые малые пептиды кодируются генами, некоторые образуются в результате расщепления препротеинов и посттрансляционных модификаций (Matsubayashi, 2014). Было также обнаружено, что пептиды, получаемые извне в качестве компонентов белковых гидролизатов или синтетически произведенные со случайными последовательностями, вызывают биологическую активность (Roy et al., 2018). Однако понимание молекулярных механизмов, лежащих в основе того, как свободные аминокислоты и их полимерные формы - пептиды и белки - поглощаются из окружающей среды, появилось лишь недавно.
Исследования биохимических процессов, опосредующих поглощение и транспорт аминокислот и пептидов, начались в 1980-х и 1990-х годах с анализов поглощения с использованием мембранных везикул, выделенных из различных растительных тканей. С помощью радиоактивно меченных субстратов и методов флуоресцентного мечения было выявлено существование нескольких систем транспорта аминокислот и пептидов (Tegeder and Rentsch, 2010). С тех пор в немикоризном модельном виде Arabidopsis thaliana были идентифицированы члены по меньшей мере десятка семейств транспортеров. Функциональные исследования - с использованием комбинации гетерологичных систем экспрессии, линий нокаута и сверхэкспрессии генов и анализа экспрессии для определения органной/тканевой локализации - выявили роль транспортеров в поглощении аминокислот из почвы, клеточном импорте и экспорте и/или дальнем транспорте по сосудистой системе растений (Tegeder, 2014).
Локализованные на плазматической мембране транспортеры, участвующие в поглощении аминокислот корнями, принадлежат к трем семействам в рамках суперсемейства транспортеров аминокислот-полиамин-холина (APC): (i) аминокислотные пермеазы (AAPs), которые функционируют как транспортеры широких субстратов с умеренным сродством; (ii) лизин/гистидиноподобные транспортеры (LHTs), которые импортируют нейтральные и кислые аминокислоты; и (iii) транспортеры пролина и глицин-бетаина (ProTs), которые переносят осмолиты пролин и глицин-бетаин (Tegeder and Masclaux-Daubresse, 2018).

AtPTR1, член семейства пептидных транспортеров/нитратных транспортеров 1 (PTR), участвует в поглощении дипептидов в корнях (Komarova et al., 2008) (Рисунок 1). Помимо этого, мало что известно о поглощении пептидов корнями, хотя другие PTR и члены семейств транспортеров АТФ-связывающих кассет (ABC) и олигопептидных транспортеров (OPT), вероятно, вовлечены в этот процесс (Tegeder and Rentsch, 2010; Roy et al., 2018).
В микоризных растениях грибы-симбионты способствуют поглощению аминокислот и пептидов. Микоризы также проявляют протеолитическую активность, которая, вместе с протеолитической активностью свободно живущих микробов в почве, делает аминокислоты, связанные в белках и пептидах, доступными для растений (Näsholm et al., 2009) (рис. 1).
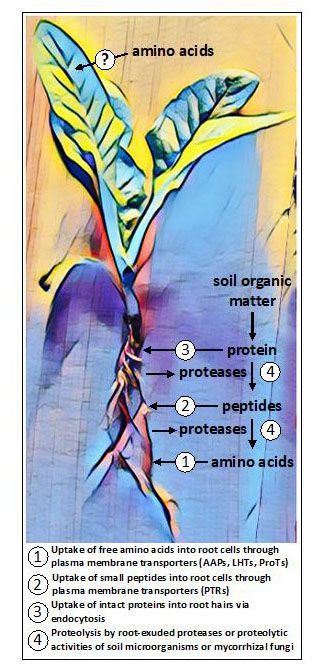
Рисунок 1. Потенциальные пути поглощения аминокислот, коллективно встречающиеся в растениях. В корнях аминокислоты могут поглощаться в свободной (мономерной) форме или в полимерной форме в виде небольших пептидов или белков. Некоторые растения выделяют протеазы для преобразования белков и пептидов в почве в свободные аминокислоты, в то время как другие растения полагаются на деятельность грибковых симбионтов для протеолиза и поглощения. Появляющиеся данные указывают на то, что некоторые растения могут приобретать аминокислоты, экзогенно вносимые в воздушные ткани, хотя предположительные пути поглощения неизвестны.
Совсем недавно было обнаружено, что корни нескольких различных немикоризных растений выделяют протеолитические ферменты, принадлежащие к семейству цистеиновых протеаз (Adamczyk et al., 2010), которые могут расщеплять белки на поверхности корня и в апопласте корневой коры (Paungfoo-Lonhienne et al., 2008). Высвобожденные малые пептиды и свободные аминокислоты затем доступны для поглощения транспортерами, локализованными в плазматической мембране. Мембраны растительных клеток также содержат рецепторные киназы с лейцин-богатым повтором (LRR-RK), которые воспринимают пептидные и белковые лиганды (Hohmann et al., 2017). Эти рецепторы образуют первый слой иммунной системы растений, а члены, экспрессированные в корнях, помогают контролировать формирование диффузионных барьеров в каспаровской полосе (Okuda et al., 2020). По имеющимся данным, неповрежденные белки также способны проникать в корневые волоски путем эндоцитоза и затем перевариваться внутри растительных клеток (Paungfoo-Lonhienne et al., 2008).
В почве растения легко конкурируют с микроорганизмами за органический азот. Микробы обладают более высокой скоростью оборота и большим отношением площади поверхности к объему, что дает им более широкий доступ к субстратам в почве. В связи с этим возникает вопрос о том, в какой степени аминокислоты, пептиды и белки служат значимыми источниками азота для растений (Näsholm et al., 2009). Поскольку экзогенно вносимые аминокислоты, пептиды и белки оказывают благотворное влияние (Colla et al., 2017b) не только на метаболизм азота, это может указывать на другие роли аминокислот и пептидов, взятых из почвы.
Хотя многие исследования были посвящены получению аминокислот из почвы, некоторые растения способны получать их через воздушные ткани. Например, в ловушках плотоядных растений, таких как виды Nepenthes, питательные вещества, высвобожденные из переваренной добычи, включая аминокислоты, пептиды и белки, извлекаются растением. После переваривания молекулы проникают через поры в кутикулу и попадают в апопласт, где эндоцитируются в клетки, а затем транслоцируются в мезофилл и далее включаются в метаболизм (Adlassnig et al., 2012).
Эпифитные растения (также известные как "воздушные растения") в основном получают влагу и питательные вещества из воздуха и другого окружающего их беспочвенного мусора. Эти непаразитические растения растут поверх других растений, к ним относятся многие виды мхов, папоротников, орхидей и бромелиевых. Эпифитные бриофиты, которые не имеют кутикулярных барьеров и развитых корневых и сосудистых систем, как показали исследования с использованием 15N-меток, могут поглощать глицин при внекорневом внесении (Song et al., 2016). Эпифитные бромелиевые, такие как "испанский мох" (Tillandsia usneoides) и "воздушное растение пузо" (T. paucifolia), являются непаразитическими монокотами с развитой сосудистой системой, которые используют свои корни для прикрепления к близлежащим растениям, а затем собирают питательные вещества, включая аминокислоты, через специализированные трихомы листьев (Nyman et al., 1987).
А как насчет других видов растений? Исследования с использованием 15N-меченыхаминокислот показали, что листья полевицы ползучей (Stiegler et al., 2013) и персикового дерева (Furuya and Umemiya, 2002) способны поглощать аминокислоты через листву. Недавнее исследование Маккоя и др. (McCoy et al., 2020) показало, что 15N,13Cглутамат с двойной меткой, экзогенно внесенный в листья полевицы, включается в пролин и γ-аминомасляную кислоту (ГАМК). Эта работа имеет большое значение, поскольку предполагает, что минерализация на поверхности листьев является незначительной судьбой для внесенных аминокислот, и демонстрирует, что экзогенно внесенные аминокислоты могут быть включены в метаболизм растений.

Было отмечено, что внекорневое применение белковых гидролизатов повышает продуктивность, устойчивость к стрессам окружающей среды и другие физиологические характеристики у ряда сельскохозяйственных видов, включая томаты (Colla et al., 2017a), плодовые деревья (Tanou et al., 2017) и сою (Teixeira et al., 2018). Несмотря на то, что в состав препаратов часто входят поверхностно-активные вещества для повышения проницаемости гидрофильных аминокислот и малых пептидов через гидрофобную кутикулу, на поглощение влияют и другие факторы, такие как климат (Pecha et al., 2012) и наличие водных пор (Schönherr, 2006).
Как только аминокислоты и пептиды пересекают кутикулярный барьер, они попадают в пространство клеточной стенки (апопласт), где могут быть поглощены одним или несколькими транспортерами, локализованными на плазматической мембране. Отсюда они могут связываться с LRR-RKs или транспортироваться в другие части растения. Наиболее вероятным путем дальнего транспорта является апопласт-флоэмный путь, который импортирует аминокислоты из апопласта во флоэму (Tegeder and Masclaux-Daubresse, 2018). Среди задействованных транспортеров есть представители того же класса AAP, которые участвуют в поглощении корнями аминокислот из почвы (Santiago and Tegeder, 2016). Интересно отметить, что функционирование апопластного флоэмного пути у растений обычно основывается на экспорте аминокислот из клеток-источников листьев в апопласт. Таким образом, можно предположить, что экзогенное поступление аминокислот через листву фактически обходит этот этап, тем самым влияя на качество плодов и архитектуру корней, наблюдаемые при применении биостимуляторов на основе гидролизата белка (Colla et al., 2015).



