L'ABSORPTION PAR LES PLANTES DES ACIDES AMINÉS ET DES PEPTIDES
Par : Joshua R. Widhalm, Département d'horticulture et d'architecture paysagère, Université Purdue, États-Unis
e-mail : jwidhalm@purdue.edu

Les acides aminés sont des éléments essentiels à la synthèse des protéines dans tous les organismes. Chez les plantes, les acides aminés libres "protéinogènes" jouent des rôles supplémentaires dans l'assimilation et le transport de l'azote, en tant que composés de signalisation, en tant qu'osmolytes et en tant que précurseurs pour la fabrication de diverses hormones, de cofacteurs et d'autres composés majeurs comme la chlorophylle. Les plantes utilisent également les acides aminés pour produire collectivement des milliers de composés spécialisés qui facilitent les interactions écologiques et fournissent des réponses adaptatives aux stress environnementaux.
Les acides aminés des plantes peuvent également être liés sous des formes polymériques en tant que petits peptides, qui sont généralement composés de 5 à 60 acides aminés. Certains petits peptides jouent des rôles semblables à ceux des hormones dans la croissance et le développement des plantes (Roy et al., 2018). D'autres fonctionnent en réponse à une blessure, une infection pathogène, un déséquilibre nutritif, une sécheresse ou une forte salinité (Chen et al., 2020). Alors que de nombreux petits peptides produits de manière endogène sont codés par les gènes, certains sont produits par le clivage de préprotéines et des modifications post-traductionnelles (Matsubayashi, 2014). On a également constaté que des peptides appliqués de manière externe, en tant que composants d'hydrolysats de protéines ou ceux produits synthétiquement avec des séquences aléatoires, suscitent des activités biologiques (Roy et al., 2018). Cependant, la compréhension des mécanismes moléculaires qui sous-tendent la façon dont les acides aminés libres et leurs formes polymériques - en tant que peptides et protéines - sont absorbés dans l'environnement n'a commencé à émerger que récemment.
Les recherches sur les processus biochimiques médiant l'absorption et le transport des acides aminés et des peptides ont commencé dans les années 1980 et 1990 avec des essais d'absorption utilisant des vésicules membranaires isolées de divers tissus végétaux. L'utilisation de substrats marqués par radioactivité et de méthodes de marquage fluorescent a révélé l'existence de multiples systèmes de transport d'acides aminés et de peptides (Tegeder et Rentsch, 2010). Depuis lors, des membres d'au moins une douzaine de familles de transporteurs ont été identifiés dans l'espèce modèle non mycorhizienne Arabidopsis thaliana. Des études fonctionnelles - utilisant une combinaison de systèmes d'expression hétérologues, de lignées de knock-out et de surexpression de gènes, et d'analyses d'expression pour déterminer la localisation dans les organes/tissus - ont révélé le rôle des transporteurs dans l'absorption des acides aminés du sol, l'importation et l'exportation cellulaire, et/ou le transport à longue distance dans tout le système vasculaire de la plante (Tegeder, 2014).
Les transporteurs localisés dans la membrane plasmique impliqués dans l'absorption des acides aminés par les racines appartiennent à trois familles de la superfamille des transporteurs d'acides aminés, de polyamine et de choline (APC) : (i) les Amino Acid Permeases (AAPs), qui fonctionnent comme de larges transporteurs de substrat avec des affinités modérées ; (ii) les Lysine/Histidine-like Transporters (LHTs), qui importent les acides aminés neutres et acides ; et (iii) les Proline and Glycine Betaine Transporters (ProTs), qui transportent les osmolytes proline et glycine bétaïne (Tegeder et Masclaux-Daubresse, 2018).

AtPTR1, un membre de la famille des transporteurs de peptides/nitrates 1 (PTR) est impliqué dans l'absorption des dipeptides dans les racines (Komarova et al., 2008) (Figure 1). Au-delà de cela, on connaît peu de choses sur l'absorption des peptides par les racines, bien que d'autres PTR et membres de la famille des transporteurs ABC (ATP Binding Cassette) et OPT (Oligopeptide Transporter) soient probablement impliqués (Tegeder et Rentsch, 2010 ; Roy et al., 2018).
Chez les plantes mycorhizées, les symbiotes fongiques contribuent à l'absorption d'acides aminés et de peptides. Les mycorhizes présentent également des activités protéolytiques qui, avec celles des microbes libres du sol, rendent les acides aminés liés aux protéines et aux peptides disponibles pour les plantes (Näsholm et al., 2009) (Figure 1).
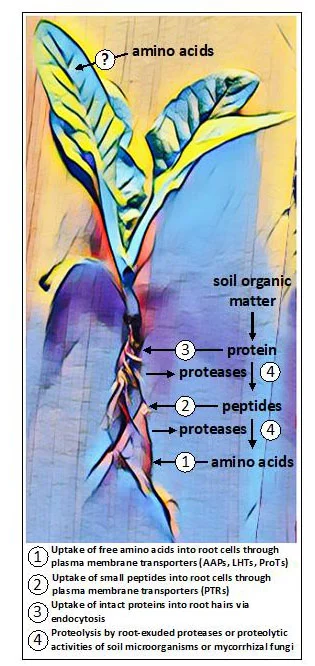
Figure 1. Voies potentielles d'absorption des acides aminés trouvées collectivement dans les plantes. Dans les racines, les acides aminés peuvent être absorbés sous leur forme libre (monomère) ou sous forme polymérique, comme de petits peptides ou protéines. Certaines plantes libèrent des protéases pour convertir les protéines et les peptides du sol en acides aminés libres, tandis que d'autres plantes dépendent des activités de symbiotes fongiques pour la protéolyse et l'absorption. De nouvelles preuves indiquent que certaines plantes peuvent être capables d'acquérir des acides aminés appliqués de manière exogène aux tissus aériens, bien que les voies présumées d'absorption soient inconnues.
Ce n'est que plus récemment que l'on a découvert que les racines de plusieurs plantes non mycorhiziennes distinctes exsudent des enzymes protéolytiques appartenant à la famille des cystéines protéases (Adamczyk et al., 2010) qui peuvent décomposer les protéines à la surface des racines et dans l'apoplaste du cortex racinaire (Paungfoo-Lonhienne et al., 2008). Les petits peptides et les acides aminés libres libérés sont alors disponibles pour être absorbés par des transporteurs localisés dans la membrane plasmique. Les membranes des cellules végétales contiennent également des récepteurs kinases à répétition riches en leucine (LRR-RK) qui détectent les ligands peptidiques et protéiques (Hohmann et al., 2017). Ces récepteurs forment la première couche du système immunitaire des plantes et les membres exprimés dans les racines aident à contrôler la formation de barrières de diffusion dans la bande caspienne (Okuda et al., 2020). Les protéines intactes seraient également capables de pénétrer dans les poils des racines par endocytose et sont ensuite digérées à l'intérieur des cellules végétales (Paungfoo-Lonhienne et al., 2008).
Dans le sol, les plantes sont facilement concurrencées par les micro-organismes pour l'azote organique. Les microbes ont des taux de renouvellement plus rapides et des rapports surface/volume plus importants, ce qui leur permet d'accéder plus facilement aux substrats dans le sol. On peut donc se demander dans quelle mesure les acides aminés, les peptides et les protéines constituent des sources importantes d'azote pour les plantes (Näsholm et al., 2009). Comme les acides aminés, les peptides et les protéines appliqués de manière exogène ont des effets bénéfiques (Colla et al., 2017b) au-delà du métabolisme de l'azote, cela peut indiquer d'autres rôles pour les acides aminés et les peptides prélevés dans le sol.
Si de nombreuses recherches ont porté sur l'acquisition d'acides aminés à partir du sol, certaines plantes sont capables de les absorber via les tissus aériens. Dans les pièges à fosse des plantes carnivores comme les espèces de Nepenthes, par exemple, les nutriments libérés par les proies digérées, notamment les acides aminés, les peptides et les protéines, sont récupérés par la plante. Après la digestion, les molécules pénètrent la cuticule par des pores et entrent dans l'apoplaste où elles sont endocytosées dans les cellules, puis transloquées vers le mésophylle et incorporées dans le métabolisme (Adlassnig et al., 2012).
Les plantes épiphytes (également appelées "plantes aériennes") tirent principalement leur humidité et leurs nutriments de l'air et des autres débris non terreux qui les entourent. Ces plantes non parasites poussent sur d'autres plantes, et comprennent de nombreux types de mousses, de fougères, d'orchidées et de broméliacées. Les bryophytes épiphytes, qui n'ont pas de barrières cuticulaires et n'ont pas de systèmes racinaires et vasculaires développés, ont été montrés par des études de marquage 15Npour absorber la glycine par application foliaire (Song et al., 2016). Les broméliacées épiphytes, comme la " mousse espagnole " (Tillandsia usneoides) et la " plante aérienne ventrue " (T. paucifolia), sont des monocotylédones non parasites dotées d'un système vasculaire réduit qui utilisent leurs racines pour s'attacher aux plantes voisines, puis recueillent des nutriments, y compris des acides aminés, via des trichomes foliaires spécialisés (Nyman et al., 1987).
Qu'en est-il des autres types de plantes ? Des études de traçage avec des acides aminés marqués au 15Nont montré que les feuilles de l'agrostide rampante (Stiegler et al., 2013) et du pêcher (Furuya et Umemiya, 2002) sont capables d'absorber des acides aminés par leur feuillage. Une étude récente de McCoy et al. (McCoy et al., 2020) a en outre démontré que le glutamate doublement marqué 15N,13Cappliqué de manière exogène au feuillage de l'agrostide rampante est incorporé dans la proline et l'acide γ-aminobutyrique (GABA). Ce travail est important car il suggère que la minéralisation à la surface des feuilles est un destin mineur pour les acides aminés appliqués et démontre que les acides aminés fournis de manière exogène peuvent être incorporés dans le métabolisme des plantes.

L'application foliaire d'hydrolysats de protéines a été observée pour augmenter la productivité, la tolérance au stress environnemental et d'autres caractéristiques physiologiques chez un certain nombre d'espèces pertinentes pour l'agriculture, notamment la tomate (Colla et al., 2017a), les arbres fruitiers (Tanou et al., 2017) et le soja (Teixeira et al., 2018). Si les applications contiennent souvent des tensioactifs pour augmenter la perméance des acides aminés hydrophiles et des petits peptides à travers la cuticule hydrophobe, d'autres facteurs, comme le climat (Pecha et al., 2012) et la présence de pores aqueux (Schönherr, 2006), affectent également l'absorption.
Une fois que les acides aminés et les peptides ont franchi la barrière cuticulaire, ils pénètrent dans l'espace de la paroi cellulaire (apoplaste) où ils peuvent être pris en charge par un ou plusieurs transporteurs localisés dans la membrane plasmique. De là, ils peuvent également - a priori - se lier aux LRR-RK ou être transportés vers d'autres parties de la plante. La voie la plus probable de transport à longue distance est la voie apoplastique du phloème, qui importe des acides aminés de l'apoplaste vers le phloème (Tegeder et Masclaux-Daubresse, 2018). Les transporteurs impliqués comprennent des membres de la même classe d'AAP contribuant à l'absorption par les racines des acides aminés du sol (Santiago et Tegeder, 2016). Il est intéressant de noter que le fonctionnement de la voie apoplastique du phloème chez les plantes repose généralement sur l'exportation des acides aminés des cellules sources foliaires vers l'apoplaste. Ainsi, on peut envisager que l'apport exogène d'acides aminés par le feuillage contourne en fait cette étape, influençant ainsi les aspects de la qualité des fruits et de l'architecture des racines observés lors de l'application de biostimulants à base d'hydrolysats de protéines (Colla et al., 2015).



