LA METABOLOMICA E IL SUO POTENZIALE PER COMPRENDERE LA MODALITÀ D'AZIONE DEI BIOSTIMOLANTI VEGETALI
A cura di: Luigi Lucini, Università Cattolica di Piacenza, Italia - email: luigi.lucini@unicatt.it

Sebbene la letteratura sia abbondantemente a sostegno dei benefici legati all'uso dei biostimolanti, i meccanismi molecolari alla base di tali effetti positivi sono ancora poco chiariti. Tuttavia, la comprensione della modalità d'azione attraverso la quale i biostimolanti esercitano la loro attività può fornire utili indicazioni per definire meglio gli obiettivi in termini di colture, indicazioni, pratiche agricole e tempi di applicazione. Inoltre, le recenti normative adottate dall'UE suggeriscono l'opportunità di comprendere i processi colturali influenzati dai biostimolanti per sostenere le indicazioni desiderate a livello normativo.
Fatta questa premessa, possiamo sottolineare che rispondere alla richiesta di cui sopra è una sfida cruciale. Ciò è dovuto principalmente a due ragioni: (i) la complessità dei processi biochimici delle piante, alcuni dei quali non ancora del tutto chiariti; (ii) la variabilità della risposta genotipica, piuttosto che da cultivar a cultivar, e il ruolo centrale di modellazione esercitato sia dall'ambiente che dalle pratiche agronomiche.
Essendo ancorate al suolo, le piante hanno dovuto sviluppare un'enorme varietà di processi biochimici per rispondere agli stress abiotici e biotici; i biostimolanti vegetali spesso mirano a modulare questi processi. Diversi approcci possono essere utilizzati per far luce sulle variazioni biochimiche imposte da fattori esterni, come l'uso di biostimolanti sulle colture. Tra questi, gli approcci non mirati sono da raccomandare perché non richiedono ipotesi a priori e sono quindi adatti a scenari complessi. Le scienze omiche (ad esempio, genomica, trascrittomica, proteomica e metabolomica) si riferiscono al profilo di geni, trascritti, proteine e metaboliti in un sistema biologico e rientrano negli approcci non mirati. Tra le diverse omiche, la metabolomica è la più vicina al genotipo ed è stata efficacemente proposta per indagare le modalità d'azione dei biostimolanti vegetali. Infatti, insieme alla modulazione dell'espressione genica, si può avere una modificazione post-traslazionale delle proteine, che si traduce infine nell'attuale profilo dei metaboliti. I recenti progressi nelle apparecchiature analitiche, come la spettrometria di massa ad alta risoluzione, la disponibilità di banche dati e la gestione dei dati (compresa l'analisi statistica multivariata e gli strumenti bioinformatici per l'interpretazione dei dati) hanno favorito l'adozione della metabolomica nelle scienze agrarie. Di conseguenza, sono state proposte differenze nelle firme metabolomiche per identificare i processi vegetali influenzati da fattori esterni come stress abiotici (salinità, siccità, inondazioni, alte temperature, ecc.), interazioni pianta-microbo e pianta-patogeno e biostimolanti (Fig. 1).
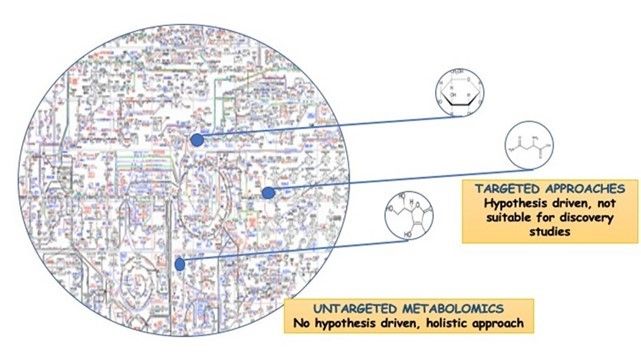
Figura 1. La metabolomica non mirata è l'analisi completa di tutti i metaboliti misurabili in un campione, compresi gli sconosciuti chimici, e la metabolomica mirata, la misurazione di gruppi definiti di metaboliti caratterizzati chimicamente e annotati biochimicamente.
Degni di nota sono i recenti progressi nella statistica multivariata, dove gli approcci di modellazione supervisionati (ad esempio, l'analisi discriminante ai minimi quadrati parziali o le proiezioni ortogonali alle strutture latenti, l'analisi discriminante delle foreste casuali) hanno integrato statistiche non supervisionate (come l'analisi dei cluster, i cluster k-means, l'analisi delle componenti principali) che consentono un trattamento adeguato dei dati, fornendo così un'identificazione più robusta delle risposte metabolomiche differenziali (Fig. 2). Questo, insieme alla disponibilità di strumenti per l'interpretazione dei dati, come l'arricchimento chimico, l'ontologia o l'analisi dei percorsi, ha dato un impulso efficace all'applicazione della metabolomica nel campo dell'agricoltura, compresi i biostimolanti vegetali (Fig. 3).

Figura 2. Analisi gerarchica dei cluster non supervisionata eseguita su profili metabolomici in seguito all'applicazione di idrolizzati proteici selezionati (figura superiore). Grafico del punteggio della modellazione supervisionata Orthogonal Projection to Latent Structures Discriminant Analysis (OPLS-DA) eseguita su profili metabolomici in seguito all'applicazione di idrolizzati proteici selezionati, dove la variazione tra i gruppi è stata separata in componenti predittive e ortogonali (figura inferiore).

Figura 3. Processi di biosintesi coinvolti nelle talee di pomodoro all'applicazione fogliare di idrolizzati proteici di origine vegetale e all'applicazione sul fusto di acido indolo-butirrico (IBA), utilizzando un'immersione rapida basale in una soluzione concentrata di IBA. L'asse delle ascisse rappresenta ogni serie di sottocategorie, mentre l'asse delle ordinate corrisponde alla variazione cumulativa di volte rispetto al controllo non trattato.
Ad esempio, la metabolomica ha permesso di identificare l'aumento della tolleranza alla salinità imposto da un idrolizzato proteico di origine vegetale nella lattuga; l'indagine ha evidenziato che l'attenuazione dello stress ossidativo, l'accumulo di osmoliti e la modulazione di steroli e terpeni sono meccanismi specifici nell'aumento della tolleranza alla salinità osservato (Lucini et al., 2015).
Analogamente, un biostimolante a base di biopolimeri di origine vegetale ha modulato positivamente il profilo metabolico delle radici nel melone, dopo la sua applicazione. I brassinosteroidi sono stati identificati come composti cardine innescati dal biostimolante, causando uno squilibrio ormonale (che coinvolge acido abscisico, citochinine e composti legati alla gibberellina) anche nei germogli (Lucini et al., 2018).
Prendendo in considerazione esempi di biostimolanti microbici, le differenze nelle impronte metaboliche hanno permesso di identificare la migliore tolleranza alla siccità esercitata dalla micorriza arbuscola (AMF) nel grano (Bernardo et al., 2019). In particolare, questo studio ha riportato una chiara interazione AMF x cultivar. Sebbene i benefici della colonizzazione arbuscolare in condizioni di limitazione idrica fossero più evidenti nel frumento panificabile, gli zuccheri e i lipidi sono risultati modulati positivamente dalla colonizzazione di AMF. È interessante notare che è stata evidenziata anche una modulazione dei metaboliti legati allo stress ossidativo e una regolazione fine del crosstalk dei fitormoni, con una stimolazione della biosintesi di brassinosteroidi nelle radici particolarmente evidente. In un altro lavoro, abbiamo aggiunto ulteriori indizi sulla complessa risposta delle colture alla colonizzazione delle radici, studiando i diversi modelli di essudazione delle radici di frumento imposti dalla micorriza arbuscolo e dal Trichoderma atroviride (Lucini et al., 2019). Questo studio ha evidenziato che la maggior parte delle differenze potrebbe essere attribuita a composti fenolici e lipidi, fitosiderofori e acidi chelanti, derivati di aminoacidi e ormoni. A prescindere dalla risposta specifica, la metabolomica ha evidenziato che l'interazione tra funghi benefici e radici di grano ha prodotto una risposta complessa in termini di essudazione radicale, la maggior parte della quale è totalmente inesplorata e potrebbe coinvolgere un'ulteriore cascata di processi.
Come si può notare da questi pochi esempi, un'ampia diversità di meccanismi è alla base della modalità d'azione dei biostimolanti vegetali, con la messa a punto della rete di crosstalk dei fito-ormoni che è un processo cardine comune (in)diretto. Per svelare in modo efficiente questi processi, potrebbe essere utile combinare la metabolomica con altri saggi, come le misure fisiologiche (scambi gassosi, fluorescenza della clorofilla, ecc.), l'attività enzimatica e i marcatori dello stress ossidativo come la malondialdeide (un marcatore della perossidazione lipidica). Tuttavia, si stanno ottenendo risultati molto promettenti quando la metabolomica viene combinata con la fenomica. In effetti, i nuovi approcci di fenotipizzazione delle piante ad alto rendimento possono essere utilizzati sia per lo screening preliminare sia per integrare i risultati della metabolomica, corroborando così le ipotesi prodotte dai metaboliti differenziali. Ad esempio, un recente lavoro su pomodori trattati con un idrolizzato proteico di origine vegetale, combinando fenotipizzazione e metabolomica, ha confermato gli effetti di mitigazione della siccità, identificando che le piante trattate mostravano una migliore tolleranza allo squilibrio delle specie reattive dell'ossigeno, probabilmente derivante da un'azione coordinata di spazzini di radicali, composti di segnalazione (acido salicilico e ammidi idrossicinnamici) e una ridotta biosintesi di coproporfirine tetrapirroliche (Paul et al., 2019a). Lo stesso approccio (fenotipizzazione vegetale high-throughput combinata con la metabolomica) è stato utilizzato con successo per vagliare diversi idrolizzati proteici di origine vegetale per l'attività biostimolante nel pomodoro (Paul et al., 2019b).
In conclusione, sebbene la metabolomica sia la "neonata" tra le altre scienze omiche, il suo potenziale per svelare i processi biochimici coinvolti nella risposta delle piante a diversi stimoli sta emergendo chiaramente. Nel campo dei biostimolanti vegetali, questa opzione potrebbe rappresentare un valido strumento per rappresentare i complessi meccanismi legati alla definizione della loro modalità d'azione.
Per maggiori informazioni, siete invitati a richiedere l'accesso ai seguenti articoli di ricerca:
Bernardo L., Carletti P., Badeck F.W., Rizza F., Morcia C., Ghizzoni R., Rouphael Y., Colla G., Terzi V., Lucini L. (2019). Le risposte metabolomiche innescate dalla micorriza arbuscola aumentano la tolleranza allo stress idrico in cultivar di frumento. Fisiologia e biochimica delle piante, 137, 203-212. https://doi.org/10.1016/j.plaphy.2019.02.007
Lucini L., Rouphael Y., Cardarelli M., Canaguier R., Kumar P., Colla G. (2015). L'effetto di un biostimolante di origine vegetale sul profilo metabolico e sulle prestazioni colturali della lattuga coltivata in condizioni saline. Scientia Horticulturae, 182, 124-133. https://doi.org/10.1016/j.scienta.2014.11.022
Lucini L., Rouphael Y., Cardarelli M., Bonini P., Baffi C., Colla G. (2018). Un biostimolante a base di biopolimeri vegetali ha promosso la crescita delle radici nel melone, attivando al contempo brassinosteroidi e composti legati allo stress. Frontiers in Plant Science, 9:472. https://doi.org/10.3389/fpls.2018.00472
Lucini L., Colla G., Miras Moreno M.B., Bernardo L., Cardarelli M., Terzi V., Bonini P., Rouphael Y. (2019). L'inoculazione di Rhizoglomus irregulare o Trichoderma atroviride modula in modo differenziato il profilo dei metaboliti degli essudati radicali di grano. Phytochemistry, 157, 158-167. https://doi: 10.1016/j.phytochem.2018.10.033
Paul K., Sorrentino M., Lucini L., Rouphael Y., Cardarelli M., Bonini P., Miras Moreno M.B., Reynaud H., Canaguier R., Trtílek M., Panzarová K., Colla G. (2019a). Un approccio fenotipico e metabolomico combinato per chiarire l'azione biostimolante di un idrolizzato proteico di origine vegetale su pomodoro coltivato in condizioni di limitata disponibilità idrica. Frontiers in Plant Science 10:493. doi: 10.3389/fpls.2019.00493
Paul K., Sorrentino M., Lucini L., Rouphael Y., Cardarelli M., Bonini P., Reynaud H., Canaguier R., Trtílek M., Panzarová K., Colla G. (2019b). Comprendere l'azione biostimolante degli idrolizzati proteici di origine vegetale attraverso la fenotipizzazione vegetale high-throughput e la metabolomica: un caso di studio sul pomodoro. Frontiers in Plant Science. 10:47. doi: 10.3389/fpls.2019.00047



