DÉCRYPTAGE DU DIALOGUE TRICHOFERME-PLANTE, IMPORTANCE DES EXSUDATS RACINAIRES
Par : Sarai Esparza-Reynoso et José López-Bucio, Instituto de Investigaciones Químico-Biológicas, Universidad Michoacana de San Nicolás de Hidalgo, Morelia, Michoacán, México.
email : sariesparza@gmail.com; jbucio@umich.mx

Les plantes, en tant que producteurs primaires des écosystèmes, hébergent une myriade d'espèces microbiennes, qui dépendent de substances riches en carbone et exsudées par les racines pour leur nutrition, notamment des sucres, des acides organiques et des acides aminés. Une grande partie du microbiome fongique et bactérien reste neutre, mais quelques espèces peuvent établir des relations pathogènes ou symbiotiques qui influencent finalement la santé, l'adaptation et la productivité des plantes (1). L'un des principaux objectifs de la gestion durable des cultures est d'identifier et de caractériser les espèces microbiennes présentant des caractéristiques probiotiques, à partir desquelles il pourrait être possible d'identifier des substances hautement actives pour développer la nouvelle génération de pesticides, de biostimulants et d'éliciteurs de défense pour le marché en expansion. Dans ce scénario, le genre fongique Trichoderma prend de plus en plus d'importance car il comprend plus de 200 espèces répertoriées au métabolisme polyvalent et aux propriétés bien adaptées pour proliférer dans les environnements du sol et de l'eau (2).
Les recherches menées au cours des deux dernières décennies ont permis de mieux comprendre les effets bénéfiques de Trichoderma sur les plantes en ce qui concerne 1) la ramification et le potentiel d'absorption des racines, 2) l'utilisation d'amendements et d'engrais organiques, 3) la croissance et le développement, et 4) l'adaptation aux défis abiotiques et biotiques. En résumé, de nombreuses espèces dont T. virens, T. atroviride et T. longibrachiatum peuvent aider les plantes à mieux survivre et à améliorer leur productivité de manière sûre et écologique. L'impact de ces champignons a été évalué dans des conditions de terrain, en corrélation avec des augmentations de rendement dans d'importantes cultures de céréales, de fruits et de légumes, notamment le maïs, le blé, le soja, la tomate, le raisin et la laitue (2).
Ces dernières années, une question majeure a été de savoir comment Trichoderma ajuste son métabolisme en fonction des niches écologiques et des ressources nutritionnelles très variables rencontrées. Apparemment, la sécrétion d'enzymes puissantes telles que les cellulases, les chitinases et les peptidases, est la caractéristique qui lui permet d'exploiter le bois mort et les matières en décomposition des feuilles, des racines et des tiges et qui souligne sa capacité à parasiter les champignons phytopathogènes. Cependant, il semble que la répression des gènes codant pour les enzymes de dégradation des champignons permette la colonisation des racines par Trichoderma et que le champignon reconnaisse ainsi les racines saines grâce à leurs profils d'exsudation (3).
Décoder le message chimique de Trichoderma
Trichoderma est un biofacteur de substances organiques et libère des volatiles, des hormones végétales, des métabolites secondaires et des petits peptides dont la composition moléculaire dépend de plusieurs facteurs dont l'espèce fongique, la disponibilité des nutriments et l'interaction avec les micro-organismes et les plantes. Ces substances infochimiques peuvent être perçues par les racines par diffusion libre dans le sol et la matière organique et lors du contact physique entre les hyphes et l'épiderme des racines, ou à des stades ultérieurs, lorsque le champignon se propage aux cellules corticales internes (4-6).
Le premier changement apparent dans la rhizosphère suite à la présence de Trichoderma est l'acidification du pH (7). Cela peut expliquer sa capacité très efficace à solubiliser les phosphates peu solubles, ce qui permet une meilleure nutrition des plantes. Au fur et à mesure de la croissance du champignon, les émissions volatiles sensibiliseraient les racines et permettraient une reconnaissance racinaire-fongique à longue distance. La 6-pentyl-2H-pyran-2-one (6-PP) est le principal volatile des mélanges de T. atroviride, qui déclenche la ramification des racines chez Arabidopsis via des changements dans le transport et la réponse de l'auxine et de l'éthylène, respectivement (4). On a constaté que le 1-décène réprime les gènes de défense, de stress et de réponse aux maladies, ce qui facilite la propagation des champignons dans les tissus racinaires (6). T. virens et T. asperellum libèrent des auxines, une classe de phytohormones ayant des rôles dans la croissance et l'immunité des plantes qui peuvent être directement liés à leurs propriétés biostimulantes (8, 9).
La reconnaissance physique peut déclencher d'autres réactions chez les partenaires fongiques et végétaux. La chitine, un constituant majeur des parois cellulaires des champignons, est depuis longtemps considérée comme un éliciteur qui déclenche des réactions défensives chez les plantes. D'autres molécules telles que les petits peptides ainsi que les protéines fongiques membranaires ou cytoplasmiques peuvent également alerter les racines pour qu'elles se préparent à l'interaction afin d'éviter les effets délétères, ce qui la rend beaucoup plus compétitive (10). Grâce à la prolifération de racines latérales et adventives, les plantes exploitent mieux les ressources minérales et hydriques et sont plus résistantes au stress abiotique, et ces processus sont efficacement induits par Trichoderma.
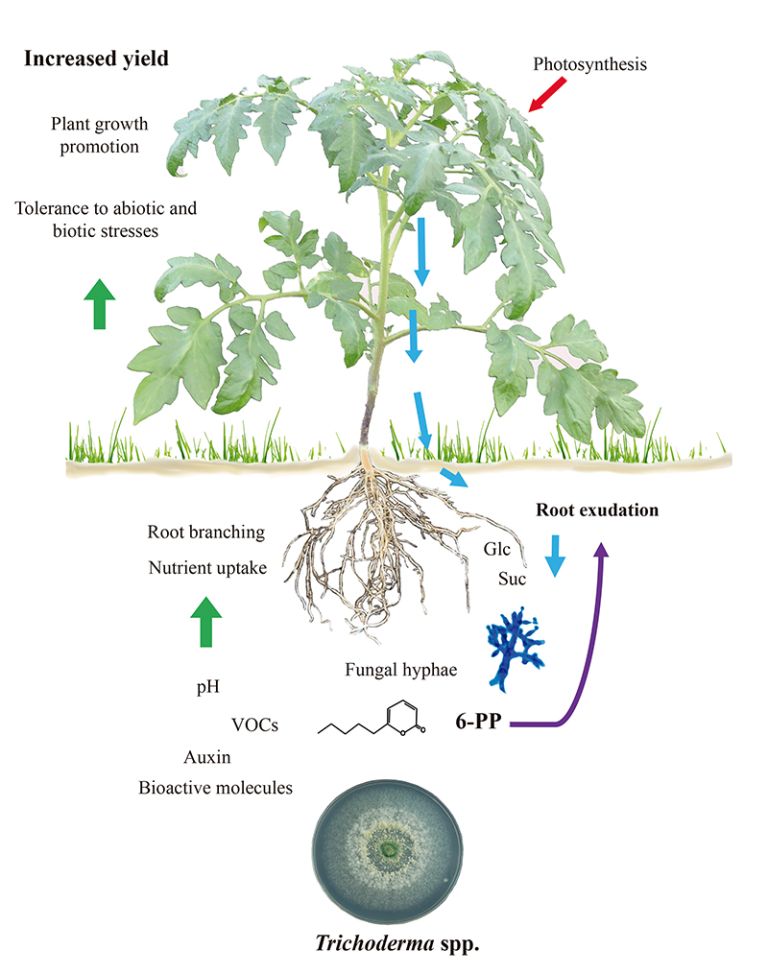
Figure 1.
Trichoderma-La croissance et la défense des plantes induites par Trichoderma dépendent des exsudats racinaires.
Les compromis croissance/défense chez les plantes sont modulés pendant les interactions biotiques. Cela permet aux transitions de développement vers la floraison de se dérouler et de justifier la production de graines. Étant donné que Trichoderma déclenche à la fois l'immunité des plantes et la promotion de la croissance, il est difficile de déterminer si ces programmes, qui sont intrinsèquement coûteux, peuvent être liés. En outre, il est possible que les racines colonisées par les champignons aient un métabolisme amélioré pour répondre à la demande énergétique de la symbiose. On a constaté que l'exsudation d'hydrates de carbone par les racines de plants de tomates augmente en réponse à T. atroviride et que les sucres peuvent agir comme une réponse chimiotactique positive pour attirer les hyphes (11), comme indiqué dans la figure 1. De manière cohérente, le champignon exprime une invertase intracellulaire (Triat51014) et deux transporteurs de saccharose putatifs (Triat226844 et Triat83012) pour utiliser le carbone d'origine végétale. En revanche, T. virens absorbe le saccharose via un transporteur de saccharose et l'hydrolyse grâce à une invertase intracellulaire, ce qui permet une croissance rapide grâce à l'énergie fournie par ce disaccharide (12).
Les preuves moléculaires permettent d'expliquer comment Trichoderma modifie ses signatures métaboliques lors de la détection des exsudats racinaires. Villalobos-Escobedo et al. (2020) sont allés plus loin en démontrant que l'expression des gènes codant pour les enzymes impliquées dans la dégradation des glucides complexes tels que la cellulose ou la chitine avant la colonisation des racines est compromise chez les mutants de T. atroviride défectueux sur la NADPH oxydase, une enzyme directement impliquée dans la production d'espèces réactives de l'oxygène. La mutation des gènes correspondants n'affecte pas seulement la formation de racines latérales et la production de biomasse dans la plante hôte, mais aussi les réactions de défense déclenchées et le comportement saprophyte du champignon pour acquérir et utiliser les sucres simples disponibles dans les exsudats racinaires (3).

Figure 2.
La question de savoir si les caractéristiques des plantes qui sous-tendent la production élevée de biomasse dans les interactions avec les microbes dépendent essentiellement du dioxyde de carbone émis a été largement débattue. Il est certain que le dioxyde de carbone est un réactif majeur pour la photosynthèse et qu'il devrait expliquer l'augmentation de la biomasse. Néanmoins, une communication étroite dépend de la composition moléculaire des mélanges volatils. En testant la croissance et le développement des plantes dans des boîtes de Pétri divisées pour évaluer l'interaction champignon-plante via les volatiles (Fig. 2), nous avons dévoilé le rôle critique du 6-PP pour la production de biomasse végétale, influençant directement les réponses hormonales, et le transport longue distance des sucres entre les pousses et les racines (Esparza-Reynoso et al. soumis). Elle soutient l'idée qu'une boucle de régulation de la distribution des sucres dépendant de la photosynthèse, du statut carbone de la pousse et de la perception des métabolites fongiques est critique pour la mitose dans les méristèmes racinaires. Il est intéressant de noter que les champignons qui favorisent la croissance des plantes, y compris les souches de Trichoderma et Serendipita indica et S. williamsii , favorisent fortement la photosynthèse par le biais de mélanges de substances volatiles et non de composés uniques (13, 14). La rétro-inhibition de la fixation du dioxyde de carbone due à des niveaux élevés de sucre ne se produit apparemment pas dans les feuilles exposées aux volatiles fongiques, peut-être en raison d'un déséquilibre hormonal. Les plantes ne sont pas seules, elles dépendent de leurs symbiotes fongiques pour survivre et prospérer. Le temps est venu de traduire les connaissances actuelles dans la mise en œuvre de Trichoderma pour des applications sur le terrain.
- Cordovez V, Dini-Andreote F, Carrión VJ, Raaijmakers JM (2019). Écologie et évolution des microbiomes végétaux. Rev. Microbiol. 73:69-88.
- López-Bucio J, Pelagio-Flores R, Herrera-Estrella A (2015). Trichoderma comme biostimulant : exploiter les propriétés multi-niveaux d'un champignon bénéfique pour les plantes. Hort. 196:109-123.
- Villalobos-Escobedo JM, Esparza-Reynoso S, Pelagio-Flores R, López-Ramírez F, Ruiz-Herrera LF, López-Bucio J, Herrera-Estrella A (2020). La NADPH oxydase fongique est un élément essentiel pour le dialogue moléculaire entre Trichoderma et Arabidopsis. Plant J. 103:2178-2192.
- Garnica-Vergara A, Barrera-Ortiz S, Muñoz-Parra E, Raya-González J, Méndez-Bravo A, Macías-Rodríguez L, Ruiz-Herrera LF, López-Bucio J (2016). La 6-pentyl-2H-pyran-2-one volatile de Trichoderma atroviride régule la morphogenèse racinaire d'Arabidopsis thaliana via la signalisation auxine et le fonctionnement d'ETHYLENE INSENSITIVE 2. New Phytol. 209:1496-1512.
- Lee S, Behringer G, Hung R, Bennett J (2019). Effets des composés organiques volatils fongiques sur la croissance et l'expression génique d'Arabidopsis thaliana . Fungal Ecol. 37:1-9.
- Guo Y, Ghirardo A, Weber B, Schnitzler JP, Benz JP, Rosenkranz M (2019). Les espèces de Trichoderma diffèrent dans leurs profils volatils et dans l'antagonisme envers l'ectomycorhize Laccaria bicolor. Microbiol. 10:891.
- Pelagio-Flores R, Esparza-Reynoso S, Garnica-Vergara A, López-Bucio J, Herrera-Estrella A (2017). L'acidificationinduite par Trichoderma est un déclencheur précoce de changements dans la croissance des racines d'Arabidopsis et détermine la phytostimulation fongique. Plant Sci. 8:822.
- Contreras-Cornejo HA, Macías-Rodríguez L, Cortés-Penagos C, López-Bucio J (2009). Trichoderma virens, un champignon bénéfique pour les plantes, améliore la production de biomasse et favorise la croissance des racines latérales par un mécanisme auxin-dépendant chez Arabidopsis. Plant Physiol. 149:1579-1592.
- Wang YF, Hou XY, Deng JJ, Yao ZH, Lyu MM, Zhang RS (2020). AUXIN RESPONSE FACTOR 1 agit comme un régulateur positif dans la réponse du peuplier à l'inoculation de Trichoderma asperellum dans les plantes surexprimées. Plants (Bâle) 9:272.
- Rocafort M, Fudal I, Mesarich CH (2020). Protéines effectrices apoplastiques des champignons et oomycètes associés aux plantes. Opin. Plant Biol. 56:9-19.
- Macías-Rodríguez L, Guzmán-Gómez A, García-Juárez P, Contreras-Cornejo HA (2018). Trichoderma atroviride favorise le développement de la tomate et modifie l'exsudation racinaire des hydrates de carbone, ce qui stimule la croissance fongique et le biocontrôle du phytopathogène Phytophthora cinnamomi dans un système d'interaction tripartite. FEMS Microbiol. Ecol. 94:fiy137.
- Vargas WA, Mandawe JC, Kenerley CM (2009). Plant-derived sucrose is a key element in the symbiotic association between Trichoderma virens and maize plants. Plant Physiol. 151:792-808.
- Harman GE, Doni F, Khadka RB, Uphoff N (2019). Les souches endophytes de Trichoderma augmentent la capacité photosynthétique des plantes. Appl. Microbiol. https://doi.org/10.1111/jam.14368.
- Venneman J. et al. (2020). LeCO2 respiratoire combiné à un mélange de volatiles émis par des souches endophytes de Serendipita stimulent fortement la croissance d'Arabidopsis impliquant la signalisation de l'auxine et de la cytokinine. Plant Sci. https://doi.org/10.3389/fpls.2020.544435.



