DESCIFRAR EL DIÁLOGO TRICOFERMA-PLANTA, IMPORTANCIA DE LOS EXUDADOS RADICULARES
Por: Sarai Esparza-Reynoso y José López-Bucio, Instituto de Investigaciones Químico-Biológicas, Universidad Michoacana de San Nicolás de Hidalgo, Morelia, Michoacán, México.
correo electrónico: sariesparza@gmail.com; jbucio@umich.mx

Las plantas, como productores primarios de los ecosistemas, albergan una miríada de especies microbianas, que dependen de sustancias ricas en carbono y exudadas por las raíces para su nutrición, incluidos azúcares, ácidos orgánicos y aminoácidos. Gran parte del microbioma fúngico y bacteriano permanece neutral, pero unas pocas especies pueden establecer relaciones patógenas o simbióticas que, en última instancia, influyen en la aptitud, la adaptación y la productividad de las plantas (1). Uno de los principales objetivos para la gestión sostenible de los cultivos es identificar y caracterizar especies microbianas con rasgos probióticos, a partir de las cuales sea posible identificar sustancias altamente activas para desarrollar la nueva generación de pesticidas, bioestimulantes y elicitores de defensa para el creciente mercado. En este escenario, el género fúngico Trichoderma está alcanzando una importancia creciente, ya que comprende más de 200 especies reportadas con metabolismo versátil y propiedades bien adaptadas para proliferar en ambientes de suelo y agua (2).
Las investigaciones de las dos últimas décadas han aumentado nuestra comprensión de los efectos beneficiosos de Trichoderma para las plantas en relación con 1) la ramificación de las raíces y el potencial de absorción, 2) el uso de enmiendas orgánicas y fertilizantes, 3) el crecimiento y el desarrollo, y 4) la adaptación a los desafíos abióticos y bióticos. En resumen, muchas especies, como T. virens, T. atroviride y T. longibrachiatum, pueden ayudar a las plantas a sobrevivir mejor y aumentar la productividad de forma segura y respetuosa con el medio ambiente. El impacto de estos hongos se ha evaluado en condiciones de campo, lo que se correlacionó con aumentos de rendimiento en importantes cultivos de cereales, frutas y verduras, como maíz, trigo, soja, tomate, uva y lechuga (2).
En los últimos años, una cuestión importante ha sido cómo Trichoderma ajusta su metabolismo en función de los nichos ecológicos altamente variables y los recursos nutricionales encontrados. Aparentemente, la secreción de potentes enzimas, como celulasas, quitinasas y peptidasas, es el sello distintivo que permite la explotación de madera muerta y materiales en descomposición de hojas, raíces y tallos, y subraya su capacidad para parasitar hongos fitopatógenos. Sin embargo, parece que la represión de los genes que codifican las enzimas degradativas de los hongos permite la colonización de las raíces por Trichoderma y, de este modo, el hongo reconoce las raíces sanas por medio de sus perfiles de exudación (3).
Descifrar el mensaje químico de Trichoderma
Trichoderma es una biofactoría de sustancias orgánicas y libera volátiles, hormonas vegetales, metabolitos secundarios y pequeños péptidos cuya composición molecular depende de varios factores, como la especie fúngica, la disponibilidad de nutrientes y la interacción con los microorganismos y las plantas. Estos infoquímicos pueden ser percibidos por las raíces a través de la difusión libre dentro del suelo y la materia orgánica y durante el contacto físico entre las hifas con la epidermis de la raíz, o en etapas posteriores, cuando el hongo se extiende a las células corticales internas (4-6).
El primer cambio aparente en la rizosfera como consecuencia de la presencia de Trichoderma es la acidificación del pH (7). Esto puede explicar su gran eficacia para solubilizar fosfatos poco solubles, lo que permite una mejor nutrición de las plantas. A medida que el hongo crece, se cree que las emisiones volátiles sensibilizan las raíces y permiten el reconocimiento a larga distancia raíz-hongo. La 6-pentil-2H-piran-2-ona (6-PP) es el principal volátil de las mezclas de T. atroviride, que desencadena la ramificación de las raíces en Arabidopsis a través de cambios en el transporte y la respuesta de auxina y etileno, respectivamente (4). Se ha descubierto que el 1-deceno reprime los genes de defensa, estrés y respuesta a enfermedades, lo que facilita la propagación de hongos en los tejidos radiculares (6). T. virens y T. asperellum liberan auxinas, una clase de fitohormonas con funciones en el crecimiento y la inmunidad de las plantas que pueden estar directamente relacionadas con sus propiedades bioestimulantes (8, 9).
El reconocimiento físico puede desencadenar otras reacciones tanto en el hongo como en la planta. La quitina, uno de los principales componentes de las paredes celulares fúngicas, se considera desde hace tiempo un elicitor que desencadena reacciones defensivas en las plantas. Otras moléculas como pequeños péptidos, así como proteínas fúngicas de membrana o citoplasmáticas, pueden alertar aún más a las raíces para que se preparen para la interacción con el fin de evitar efectos deletéreos, haciéndola mucho más competitiva (10). Mediante la proliferación de raíces laterales y adventicias, las plantas aprovechan mejor los recursos minerales e hídricos y son más resistentes al estrés abiótico, y estos procesos son inducidos eficazmente por Trichoderma.
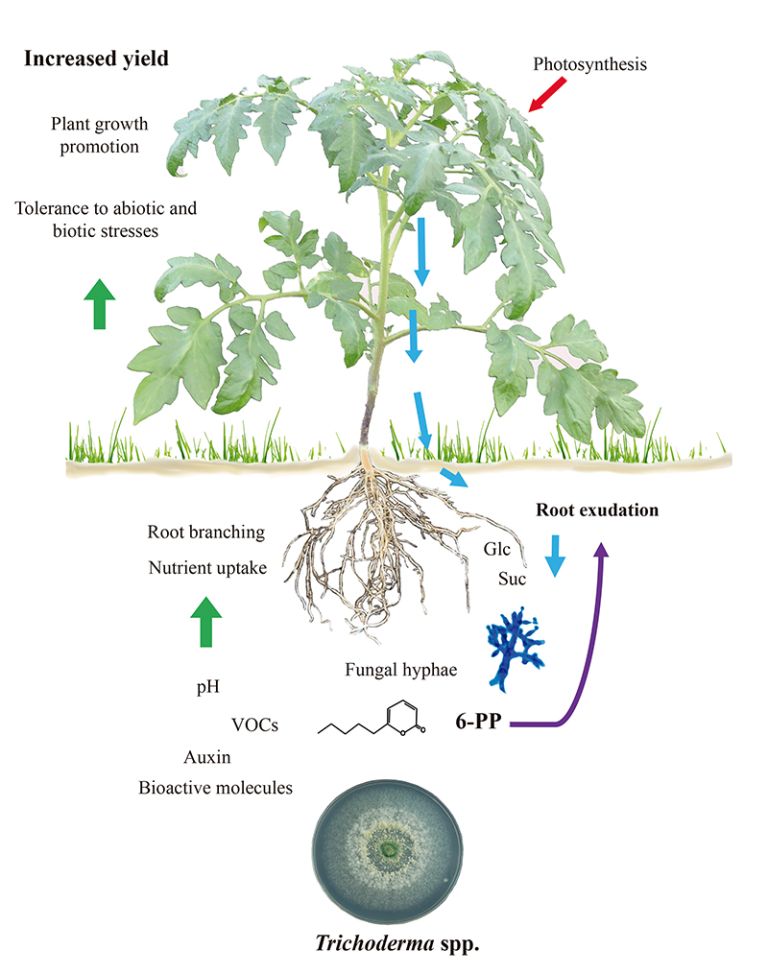
Figura 1.
Trichoderma-El crecimiento y la defensa de las plantas inducidos por Trichoderma dependen de los exudados radiculares.
Los equilibrios entre crecimiento y defensa en las plantas se modulan durante las interacciones bióticas. De este modo se garantiza la transición del desarrollo a la floración y la producción de semillas. Dado que Trichoderma desencadena tanto la inmunidad de la planta como la promoción del crecimiento, es difícil determinar si estos programas, que son inherentemente costosos, pueden estar relacionados. Además, es posible que las raíces colonizadas por hongos tengan un metabolismo mejorado para soportar la demanda energética de la simbiosis. Se ha observado que la exudación de carbohidratos por las raíces de las plántulas de tomate aumenta en respuesta a T. atroviride y que los azúcares pueden actuar como una respuesta quimiotáctica positiva para atraer a las hifas (11), tal y como se muestra en la figura 1. En consecuencia, la exudación de carbohidratos por las raíces de las plántulas de tomate aumenta en respuesta a T. atroviride. Consistentemente, el hongo expresa una invertasa intracelular (Triat51014) y dos transportadores putativos de sacarosa (Triat226844 y Triat83012) para utilizar el carbono derivado de las plantas. Por otro lado, T. virens capta la sacarosa a través de un transportador de sacarosa y la hidroliza mediante una invertasa intracelular, lo que permite un crecimiento rápido gracias a la energía proporcionada por este disacárido (12).
La evidencia molecular ayuda a explicar cómo Trichoderma cambia sus firmas metabólicas al detectar exudados radiculares. Villalobos-Escobedo et al. (2020) fueron más allá al demostrar que la expresión de genes que codifican enzimas implicadas en la degradación de carbohidratos complejos como la celulosa o la quitina antes de la colonización de la raíz se ve comprometida en mutantes de T. atroviride defectuosos en NADPH oxidasa, una enzima directamente implicada en la producción de especies reactivas de oxígeno. La mutación de los genes correspondientes no sólo afecta a la formación de raíces laterales y a la producción de biomasa en la planta hospedadora, sino que también afecta a las reacciones de defensa provocadas y al comportamiento saprofítico del hongo para adquirir y utilizar los azúcares simples disponibles en los exudados radiculares (3).

Figura 2.
Se ha debatido ampliamente si los rasgos vegetales que subyacen a la elevada producción de biomasa en las interacciones con microbios dependen esencialmente del dióxido de carbono emitido. Ciertamente, el dióxido de carbono es uno de los principales reactivos de la fotosíntesis y debería explicar el aumento de la biomasa. Sin embargo, la estrecha comunicación depende de la composición molecular de las mezclas volátiles. Probando el crecimiento y desarrollo de la planta en placas de Petri divididas para evaluar la interacción hongo-planta vía volátiles (Fig. 2), hemos desvelado el papel crítico del 6-PP para la producción de biomasa vegetal influyendo directamente en las respuestas hormonales, y en el transporte de azúcares a larga distancia brote-raíz (Esparza-Reynoso et al. presentado). Esto apoya la noción de que un bucle regulador para la distribución de azúcares dependiendo de la fotosíntesis, el estado del carbono del brote y la percepción de metabolitos fúngicos son críticos para la mitosis en los meristemos radiculares. Curiosamente, los hongos promotores del crecimiento de las plantas, incluyendo las cepas de Trichoderma y Serendipita indica y S. williamsii , promueven fuertemente la fotosíntesis no por medio de compuestos únicos, sino a través de mezclas de volátiles (13, 14). La inhibición por retroalimentación de la fijación de dióxido de carbono debida a niveles elevados de azúcar aparentemente no se produce en hojas expuestas a volátiles fúngicos, posiblemente debido a un desequilibrio hormonal. Las plantas no están solas, dependen de sus simbiontes fúngicos para sobrevivir y prosperar. Ha llegado el momento de traducir los conocimientos actuales en la aplicación de Trichoderma en el campo.
- Cordovez V, Dini-Andreote F, Carrión VJ, Raaijmakers JM (2019). Ecología y evolución de los microbiomas vegetales. Rev. Microbiol. 73:69-88.
- López-Bucio J, Pelagio-Flores R, Herrera-Estrella A (2015). Trichoderma como bioestimulante: explotando las propiedades multinivel de un hongo beneficioso para las plantas. Hort. 196:109-123.
- Villalobos-Escobedo JM, Esparza-Reynoso S, Pelagio-Flores R, López-Ramírez F, Ruiz-Herrera LF, López-Bucio J, Herrera-Estrella A (2020). La NADPH oxidasa fúngica es un elemento esencial para el diálogo molecular entre Trichoderma y Arabidopsis. Plant J. 103:2178-2192.
- Garnica-Vergara A, Barrera-Ortiz S, Muñoz-Parra E, Raya-González J, Méndez-Bravo A, Macías-Rodríguez L, Ruiz-Herrera LF, López-Bucio J (2016). El volátil 6-pentil-2H-piran-2-ona de Trichoderma atroviride regula la morfogénesis radicular de Arabidopsis thaliana vía señalización de auxina y funcionamiento de ETILENO INSENSITIVO 2. New Phytol. 209:1496-1512.
- Lee S, Behringer G, Hung R, Bennett J (2019). Efectos de los compuestos orgánicos volátiles fúngicos en el crecimiento y la expresión génica de Arabidopsis thaliana . Fungal Ecol. 37:1-9.
- Guo Y, Ghirardo A, Weber B, Schnitzler JP, Benz JP, Rosenkranz M (2019). Las especies de Trichoderma difieren en sus perfiles volátiles y en el antagonismo hacia la ectomicorriza Laccaria bicolor. Microbiol. 10:891.
- Pelagio-Flores R, Esparza-Reynoso S, Garnica-Vergara A, López-Bucio J, Herrera-Estrella A (2017). La acidificacióninducida por Trichoderma es un desencadenante temprano de cambios en el crecimiento radicular de Arabidopsis y determina la fitoestimulación fúngica. Plant Sci. 8:822.
- Contreras-Cornejo HA, Macías-Rodríguez L, Cortés-Penagos C, López-Bucio J (2009). Trichoderma virens, un hongo beneficioso para las plantas, mejora la producción de biomasa y promueve el crecimiento de raíces laterales a través de un mecanismo dependiente de auxina en Arabidopsis. Plant Physiol. 149:1579-1592.
- Wang YF, Hou XY, Deng JJ, Yao ZH, Lyu MM, Zhang RS (2020). AUXIN RESPONSE FACTOR 1 acts as a positive regulator in the response of Poplar to Trichoderma asperellum inoculation in overexpressing plants. Plants (Basilea) 9:272.
- Rocafort M, Fudal I, Mesarich CH (2020). Apoplastic effector proteins of plant-associated fungi and oomycetes. Opin. Plant Biol. 56:9-19.
- Macías-Rodríguez L, Guzmán-Gómez A, García-Juárez P, Contreras-Cornejo HA (2018). Trichoderma atroviride promueve el desarrollo del tomate y altera la exudación radicular de carbohidratos, lo que estimula el crecimiento fúngico y el biocontrol del fitopatógeno Phytophthora cinnamomi en un sistema de interacción tripartita. FEMS Microbiol. Ecol. 94:fiy137.
- Vargas WA, Mandawe JC, Kenerley CM (2009). La sacarosa derivada de plantas es un elemento clave en la asociación simbiótica entre Trichoderma virens y plantas de maíz. Plant Physiol. 151:792-808.
- Harman GE, Doni F, Khadka RB, Uphoff N (2019). Cepas endofíticas de Trichoderma aumentan la capacidad fotosintética de las plantas. Appl. Microbiol. https://doi.org/10.1111/jam.14368.
- Venneman J. et al. (2020). RespiratoryCO2 combined with a blend of volatiles emitted by endophytic Serendipita strains strongly stimulate growth of Arabidopsis implicating auxin and cytokinin signaling. Plant Sci. https://doi.org/10.3389/fpls.2020.544435.



